Ошибка.
Попробуйте повторить позже
Растворимость аммиака составляет 640 л (н. у.) в литре воды. Растворимость хлороводорода — 448 л (н. у.) в литре воды. Насыщенный раствор аммиака смешали с насыщенным раствором хлороводорода. При этом все вещества прореагировали полностью. К полученному раствору добавили 120 г воды и раствор нитрата
серебра. При этом образовалось 760 г раствора с массовой долей единственного растворённого вещества 21,05%. Вычислите массовую долю нитрата серебра в добавленном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Ошибка.
Попробуйте повторить позже
Растворимость аммиака составляет 640 л (н. у.) в литре воды. Растворимость хлороводорода — 448 л (н. у.) в литре воды. Насыщенный раствор аммиака смешали с насыщенным раствором хлороводорода. При этом все вещества прореагировали полностью. К полученному раствору добавили 120 г воды и раствор нитрата серебра. При этом образовалось 760 г раствора с массовой долей единственного растворённого вещества 21,05% . Вычислите массовую долю нитрата серебра в добавленном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
NH3 + HCl = NH4Cl
AgNO3 + NH4Cl = NH4NO3 + AgCl
Расчёт количества веществ и масса реагентов и продуктов:
m(NH4NO3) = 760*0.2105 = 160 г
n(NH4NO3) = 160 / 80 = 2 моль
n(NH3) = n(HCl) = n(AgNO3) = n(AgCl) = n(NH4NO3) = 2 моль
V(NH3) = V(HCl) = 44.8 л
m(NH3) = 2 * 17 = 34 г
m(HCl) = 2 * 36,5 = 73 г
m(H2O в р-ре NH3) = (44.8 * 1000) : 640 = 70 г (следствие из пропорции)
m(H2O в р-ре HCl) = (44,8 * 1000) : 448 = 100 г (следствие из пропорции)
m (AgCl) = 2 * 143,5 = 287 г
m(AgNO3) = 170 * 2 = 340 г
Расчёт массы раствора и массовая доля нитрата серебра:
m(р-ра AgNO3) = 640 - 100 - 70 - 34 - 73 + 287 = 650 г
w(AgNO3) = 340 : 650 * 100 = 52,3%
Ошибка.
Попробуйте повторить позже
Магний массой 4,8 г растворили в 200 мл 12% -ного раствора серной кислоты (р = 1,05 г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
1) Составим уравнение химической реакции между магнием и серной кислотой:
Mg + H2SO4 = MgSO4 + H2
2) Рассчитаем количества и массы веществ, полученных в ходе реакции:
n(Mg) = n(MgSO4) = n(H2) = m(Mg)/M(Mg) = 4,8 / 24 = 0,2 моль,
n(H2SO4) = 1,05 * 200 * 0,12 / 98 = 0,26 моль - в избытке,
m(MgSO4) = n(MgSO4) * M(MgSO4) = 0,2 * 120 = 24 г
m(H2) = n(H2) * M(H2) = 0,2 * 2 = 0,4 г
3) Вычислим массу раствора серной кислоты:
m1(раствора) = p * V(H2SO4) = 1,05 * 200 = 210 г
m2(раствора) = m1(раствора) + m(Mg) - m(H2) = 210 + 4,8 - 0,4 = 214,4 г
4) В завершение найдем массовую долю сульфата магния в растворе:
w(MgSO4) = m(MgSO4) / m2(раствора) = 24 / 214,4 = 0,112 или 11,2%
Ошибка.
Попробуйте повторить позже
Растворимость оксида серы (IV) составляет 40 л (н.у.) на 1 л воды, а растворимость хлора − 2,24 л (н.у.) на 1 л воды. Смешали их насыщенные растворы, при этом вещества прореагировали полностью. К полученному раствору добавили раствор гидроксида бария. Масса конечного раствора, имеющего нейтральную среду, составила 2080 г, а массовая доля единственного растворенного вещества составила 1%. Вычислите массовую долю гидроксида бария в добавленном растворе.
Запишем уравнения реакций
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
2HCl + Ba(OH)2 = BaCl2 + 2H2O
H2SO4 + Ba(OH)2 = BaSO4 ↓ + 2H2O
Вычислим количество исходных веществ
m(BaCl2) = m(p-pa) • ω = 2080 • 0,01 = 20,8 г
n(BaCl2) = m : M = 20,8 : 208 = 0,1 моль
n(Cl2) = n(BaCl2) = 0,1 моль
n(SO2) = n(Cl2) = 0,1 моль
V(Cl2) = V(SO2) = VM • n = 22,4 • 0,1 = 2,24 л
m(H2O) = 1000 • 1 = 1000 г
2,24 : 1000 = 2,24 : х
х = 1000 г
mp-pa(Cl2) = 1000 + 71 • 0,1 = 1007,1 г
40 : 1000 = 2,24 : y
y = 56 г
mp-pa(SO2) = 56 + 64 • 0,1 = 62,4 г
Вычислим массу раствора гидроксида бария
m(конеч. р-ра) = mp-pa(Cl2) + mp-pa(SO2) + mp-pa(Ba(OH)2) − m( BaSO4) = 2080 г
m(конеч. р-ра) = 1007,1 + 62,4 + mp-pa(Ba(OH)2) − 233 • 0,1 = 2080 г
mp-pa(Ba(OH)2) = 2080 + 23,3 − 62,4 − 1007,1 = 1033,8 г
Вычислим массовую долю гидроксида бария в добавленном растворе
m( Ba(OH)2) = n • M = (0,1 + 0,1) • 171 = 34,2 г
ω(Ba(OH)2) = 34,2 : 1033,8 • 100% = 3,308%
Ошибка.
Попробуйте повторить позже
Растворимость бромоводорода 560 л (н.у ) на 1 л воды. Растворимость аммиака 640 л (н.у) на литр воды. Смешали насыщенные растворы аммиака и бромоводорода, все вещества прореагировали полностью. Затем добавили раствор нитрата серебра, образовался раствор 1000 г с массовой долей единственного растворенного вещества 24%. Вычислите массовую долю нитрата серебра в добавленном растворе.
HBr + NH3 → NH4Br
NH4Br + AgNO3 → AgBr + NH4NO3
Единственным растворённым веществом может быть только NH4NO3, отсюда следует, что AgNO3 и NH4Br прореагировали полностью.
m(NH4NO3) = 1000*0,24 = 240 г
n(NH4NO3) = 240 / 80 = 3 моль
Если NH3 и HBr прореагировали полностью, то n(NH3) = n(HBr) = n(NH4Br) = 3 моль
Используя растворимость газов, найдём их растворы:
n(HBr) = 560 / 22,4 = 25 моль ⇒ m(HBr) = 25*81 = 2025 г
m(H2O) = 1000*1 = 1000 г
m(HBr)р-ра = m(HBr) + m(H2O) + 2025 + 1000 = 3025 г
В 3025 г - 25 моль HBr
В х г - 3 моль HBr
х = 363
Для NH3:
n(NH3) = 640 / 22,4 = 28,571 моль ⇒ m(NH3) = 28,571*17 = 485,707
m(H2O) = 1000*1 = 1000 г
m(NH3)р-ра = m(H2O) + m(NH3) = 485,707 + 1000 = 1485,707 г
В 1485,707 г - 28,571 моль NH3
В y г - 3 моль NH3
y = 156
Зная общую массу раствора, можно найти массу раствора AgNO3:
mкон.р-ра= m(NH3) + m(HBr) + m(AgNO3) - m(AgBr) = 1000 г
156 + 363 + m(AgNO3)р-ра - 3*188 = 1000 г
m(AgNO3)р-ра = 1045 г
m(AgNO3) = 3*170 = 510 г
w(AgNO3) = 510 / 1045 * 100% = 48,8%
Ошибка.
Попробуйте повторить позже
Растворимость оксида серы (IV) составляет 40 л (н.у) в литре воды. Растворимость хлора 2,24 л (н.у) в литре воды. Насыщенный раствор оксида серы (IV) смешали с насыщенным раствором хлора, все вещества прореагировали полностью. К полученному раствору добавили раствор гидроксида бария, при этом образовалось 2080 г нейтрального раствора с массовой долей единственного растворенного вещества 1%. Вычислите массовую долю гидроксида бария в добавленном растворе.
В 1114,304 г раствора - 1,786 моль SO2
В х г раствора - 0,1 моль SO2
x = 62,4
Для Cl2:
n(Cl2) = 2,24 / 22,4 = 0,1 моль, следовательно m(Cl2) = 0,1*71 = 7,1 г
m(нас.р-ра по условию) = m(H2O) + m(Cl2) = 1000*1 + 7,1 = 100,1 г
В 1007,1 г р-ра - 0,1 моль Cl2
В y г р-ра - 0,1 моль Cl2
y = 1007,1
m(конц.р-ра) = m(SO2) + m(Cl2) + m(Ba(OH)2) - m(BaSO4) = 62,4 + 1007,1 + m(р-ра Ba(OH)2) - 0,1*233 = 1046,2 + m(р-ра Ba(OH)2)
Известно, что масса конечного раствора равна 2080 г:
1046,2 + m(р-ра Ba(OH)2) = 2080
m(р-ра Ba(OH)2) = 1033,8 г
m(Ba(OH)2)всего = (0,1+0,1)*171 = 34,2 г
w(Ba(OH)2) = 34,2 / 1033,8 * 100 = 3,31%
Ошибка.
Попробуйте повторить позже
Растворимость оксида серы (IV) составляет 40 л (н.у) в литре воды. Растворимость хлора 2,24 л (н.у) в литре воды. Насыщенный раствор оксида серы (IV) смешали с насыщенным раствором хлора, все вещества прореагировали полностью. К полученному раствору добавили раствор гидроксида бария, при этом образовалось 2080 г нейтрального раствора с массовой долей единственного растворенного вещества 1%. Вычислите массовую долю гидроксида бария в добавленном растворе.
SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Единственным растворённым веществом в растворе может быть только образовавшийся BaCl2 в ходе третьей реакции.
m(BaCl2) = 2080*0,01 = 20,8 г
n(BaCl2) = 20,8 / 208 = 0,1 моль
n3(HCl) = n1(HCl) = 0,2 моль
Учитывая, что SO2 и Cl2 прорерагировали полностью, получаем:
n(SO2) = 0,1 моль
n(Cl2) = 0,1 моль
Используя данные про растворимость, узнаем массы растворов газов:
для SO2:
n(SO2) = 40 / 22,4 = 1,786 моль
Следовательно, m(SO2) = 1,786*64 = 114,304 г
m(нас. р-ра по условию) = m(H2O) + m(SO2) = 1000*1 + 114,304 = 1114,304 г
Ошибка.
Попробуйте повторить позже
Нитрат алюминия частично разложился при нагревании, при этом выделилось 13,44 л газов (н.у.). Чтобы полностью растворить неразложившуюся соль, достаточно 72 мл воды (s = 71 г/100 г воды). Вычислите минимальную массу 20%-го раствора гидроксида калия, необходимую для полного растворения полученного при прокаливании твердого остатка.

Ошибка.
Попробуйте повторить позже
Растворимость хлороводорода при нормальных условиях составляет 448 л на 1 л воды. При этих условиях приготовили насыщенный раствор, растворив необходимое количество хлороводорода в 100 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток цинка. К раствору во второй колбе добавили 300 г раствора карбоната калия, также взятого в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида калия в конечном растворе во второй колбе
Состваим пропорцию:
448 / х = 1 / 0,1
х - объём растворённого HCl
V HCl = 448 / 0,1 = 44,8 л
n HCl = 44,8 / 22,4 = 2 моль
W HCl = m HCl / m р-ра = (2 * 36,5) / (73 + 100) = 0,42 или 42%
1 колба:
Zn + 2HCl = ZnCl2 + H2
2 колба:
K2CO3 + 2HCl = 2KCl + CO2 + H2O
Пусть n H2 - х моль, а n CO2 - y моль. Тогда, на основе условий задачи, составим систему уравнения:
1,5х = у
2х + 2у = 2
х = 0,4
у = 0,6
n KCl = 2n CO2 = 1,2 моль
m кон. р-ра = m р-ра HCl + m р-ра K2CO3 - m CO2
m р-ра HCl = m HCl / W НСl = (1,2 * 36,5) / 0,42 = 104,3 г
m CO2 = 0,6 * 44 = 26,4 г
m кон. р-ра = 104,3 + 300 - 26,4 = 377,9 г
m KCl = 1,2 * 74,5 = 89,4 г
W KCl = m KCl / m кон. р-ра = 89,4 / 377,9 = 0,237 или 23,7%
Ответ: W KCl = 0,237 или 23,7%
- 23,7
- 23.7
- 0,237
- 0.237
Ошибка.
Попробуйте повторить позже
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе
Масса раствора, содержащего 53,4 г соли, равняется 153,4 г. Необходимо найти массу соли в растворе массой 306,8 г. Решая пропорцию, находим массу соли: 106,8 г.
n(AlCl3) = 106,8 / 133,5 = 0,8 моль
Запишем уравнения реакций:
1) 2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KCl
2) AlCl3 + 3NH3∙H2O = Al(OH)3 + 3NH4Cl
Пусть в первую реакцию вступило х моль хлорида алюминия, а во вторую реакцию - у моль. По уравнениям реакций, в первой реакции образовалось х моль гидроксида алюминия, а во второй реакции - у моль гидроксида алюминия. По условию, масса осадка во второй колбе в 3 раза больше таковой в первой колбе:
у / х = 3
А общее количество хлорида алюминия равняется 0,8 моль:
х + у = 0,8
Решая данную систему, находим переменные: х = 0,2 моль, у = 0,6 моль.
В исходном растворе хлорида алюминия массой 306,8 г содержалось 0,8 моль соли. Необходимо найти массу раствора, в котором содержится 0,6 моль соли. Решая данную пропорцию, находим массу раствора: 230,1 г.
Найдем массу конечного раствора во второй колбе:
mр-ра = 230,1 + 300 - 78 * 0,6 = 483,3 г
n(NH4Cl) = 3у = 1,8 моль
m(NH4Cl) = 53,5 * 1,8 = 96,3 г
w(NH4Cl) = 96,3 / 483,3 = 0,1993 (19,93%)
Ответ: w(NH4Cl) = 19,93%
- 19,93
- 19.93
- 0,1993
- 0.1993
Ошибка.
Попробуйте повторить позже
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
При растворении 15,6 г соли в 100 г воды получим раствор массой 115,6 г, в котором находится 15,6 г соли, тогда в 289 г раствора находится z г соли.
Решая данную пропорцию, получаем, что масса соли в растворе массой 289 г составляет 39 г.
n(Na2S) = 39 / 78 = 0,5 моль
Запишем уравнения реакций:
1) 3Na2S + 2AlCl3 + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
2) Na2S + 2HCl = 2NaCl + H2S
Пусть в первую реакцию вступило х моль сульфида натрия, а во вторую реакцию - у моль. По уравнениям реакции в первой реакции выделилось х моль сероводорода, а во второй реакции - у моль сероводорода. По условию во второй реакции выделилось в 1,5 раза больше газа, чем в первой:
y / х = 1,5
Суммарное количество сульфида натрия равняется 0,5 моль:
х + у = 0,5
Решая данную систему уравнений, получаем, что х = 0,2 моль, у = 0,3 моль
В растворе массой 289 г содержится 0,5 моль соли, необходимо найти массу раствора, в котором содержится 0,3 моль соли. Решая данную пропорцию, находим массу такого раствора: 173,4 г.
Найдем конечную массу раствора во второй колбе:
mр-ра = 173,4 + 100 - 34 * 0,3 = 263,2 г
n(NaCl) = 2y = 0,6 моль
m(NaCl) = 0,6 * 58,5 = 35,1 г
w(NaCl) = 35,1 / 262,2 = 0,1334 (13,34%)
Ответ: w(NaCl) = 13,34%
- 13.34
- 13,34
- 0,1334
- 0.1334
Ошибка.
Попробуйте повторить позже
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: W(NaNO3) = 22,07%
- 22,07
- 22.07
- 0,2207
- 0.2207
Ошибка.
Попробуйте повторить позже
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор карбоната натрия массой 395,4 г. Приготовленный раствор разделили на две части. К первой части прилили избыток раствора нитрата кальция, при этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
1) Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
2) Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
m(Na2CO3) = 395,4 * 31,8 / (31,8 +100) = 95,4 г
n(Na2CO3) = 95,4 / 106 = 0,9 моль
n(CaCO3) = 50 / 100 = 0,5 моль
n1(Na2CO3) = n(CaCO3) = 0,5 моль
n2(Na2CO3) = 0,9 - 0,5 = 0,4 моль
m(HNO3) = 252 * 0,3 = 75,6 г
n(HNO3) = 75,6 / 63 = 1,2 моль - избыток
n(HNO3)ост. = 1,2 - (0,4 * 2) = 0,4 моль
m(HNO3)ост. = 0,4 * 63 = 25,2 г
n(CO2) = n2(Na2CO3) = 0,4 моль
m(CO2) = 44 * 0,4 = 17,6 г
Вычислена массовая доля азотной кислоты в растворе:
m(p-pa Na2CO3) = 395,4 * 0,4 / 0,9 =175,7 г (вторая часть раствора)
m(конечн. р-ра) = 175,7 + 252 - 17,6 = 410,1 г
W(HNO3) = 25,2 / 410,1 = 0,06 или 6%
Ответ: W(HNO3) = 6%
- 0.06
- 0,06
- 6
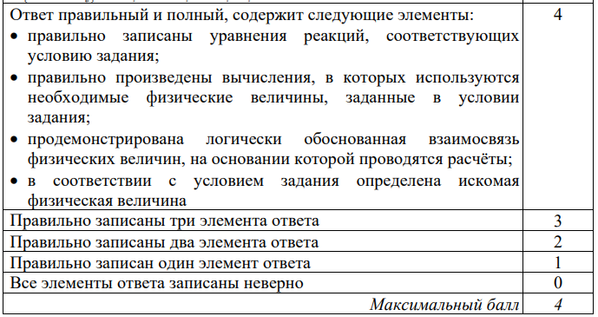
Ошибка.
Попробуйте повторить позже
При растворении 25 г медного купороса (CuSO4 * 5H2O) в воде был получен 20%-й раствор соли. К этому раствору добавили измельченную смесь, образовавшуюся в результате прокаливания порошка алюминия массой 2,16 г с оксидом железа (III) массой 6,4 г. Определите массовую долю сульфата меди (II) в полученном растворе.
1) Fe2O3 + 2Al = 2Fe + Al2O3
2) Fe + CuSO4 = FeSO4 + Cu
n(Fe2O3) = 6,4 / 160 = 0,04 моль
n(Al) = 2,16 / 27 = 0,08 моль
n(Fe) = n(Al) = 0,08 моль
m(Fe) = 56 * 0,08 = 4,48 г
n(CuSO4 * 5H2O) = 25 / 250 = 0,1 моль
n(CuSO4)исх = n(CuSO4 * 5H2O) = 0,1 моль - избыток
m(CuSO4)исх = 0,1 * 160 = 16 г
mр-ра(СuSO4)исх = 16 / 0,2 = 80 г
n(CuSO4)прореаг. = n(Fe) = 0,08 моль
n(Cu) = n(Fe) = 0,08 моль
m(Cu) = 0,08 * 64 = 5,12 г
n(CuSO4)ост = 0,1 - 0,08 = 0,02 моль
m(CuSO4)ост = 0,02 * 160 = 3,2 г
Найдена массовая доля сульфата меди (II) в образовавшемся растворе
mр-ра кон. = 80 + 4,48 - 5,12 = 79,36 г
w(CuSO4) = 3,2 / 79,36 = 0,04 или 4%
Ошибка.
Попробуйте повторить позже
При растворении в воде 57,4 г цинкового купороса (ZnSO4*7H2O) получили 20%-ный раствор соли. К полученному раствору добавили 14,4 магния. После завершения реакции к полученной смеси прибавили 292 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
n(ZnSO4 * 7H2O) = 57,4 г / 287 г/моль = 0,2 моль
n(ZnSO4) = n(ZnSO4 * 7H2O) = 0,2 моль
m(ZnSO4) = 0,2 моль * 161 г/моль = 32,2 г
mр-р.1 = 32,2 г / 0,2 = 161 г
ZnSO4 + Mg > MgSO4 + Zn
n(Mg) = 14,4 г / 24 г/моль = 0,6 моль
n(MgSO4) = n(Zn) = n(ZnSO4) = 0,2 моль
n(Mg)ост = 0,6 моль – 0,2 моль = 0,4 моль
m(HCl) = 292 г * 0,25 = 73 г
n(HCl) = 73 г / 36,5 г/моль = 2 моль
Mg + 2HCl > MgCl2 + H2
n(HCl)2 = 2n(Mg)ост = 0,8 моль
Zn + 2HCl > ZnCl2 + H2
n(HCl)3 = 2n(Zn) = 0,4 моль
n(HCl)ост = 2 моль – 0,4 моль – 0,8 моль = 0,8 моль
m(HCl)ост = 0,8 моль * 36,5 г/моль = 29,2 г
n(H2) = 0,4 моль + 0,2 моль = 0,6 моль
m(H2) = 0,6 моль * 2 г/моль = 1,2 г
mкон.р-р = 161 г + 14,4 г + 292 г – 1,2 г = 466,2 г
w(HCl)ост = 29,2 г / 466,2 г = 0,0626
ОТВЕТ: w(HCl)ост = 0,0626 или 6,26%
Ошибка.
Попробуйте повторить позже
Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
Составим пропорцию:
12,6 / 112,6 = x / 450,4
Откуда получаем x = 50,4
n(NaHCO3) = 50,4 г / 84 г/моль = 0,6 моль
NaHCO3 + Ba(OH)2 > BaCO3 + H2O + NaOH
n(BaCO3) = 39,4 г / 197 г/моль = 0,2 моль
n(NaHCO3)1 = n(BaCO3) = 0,2 моль
n(NaHCO3)2 = 0,6 моль – 0,2 моль = 0,4 моль
2NaHCO3 + H2SO4 > Na2SO4 + 2H2O + 2CO2
m(H2SO4) = 245 г * 0,2 = 49 г
n(H2SO4) = 49 г / 98 г/моль = 0,5 моль
n(H2SO4)ост = 0,5 моль – 0,2 моль = 0,3 моль
m(H2SO4)ост = 0,3 моль * 98 г/моль = 29,4 г
Считаем, что соль распределена в р-ре равноценно.
Тогда в первой колбе 0,2 моль гидрокарбоната,
во второй колбе 0,4 моль гидрокарбоната.
Следовательно исходный р-р разлили по колбам в отношении 1:2.
n(CO2) = n(NaHCO3)2 = 0,4 моль
m(CO2) = 0,4 моль * 44 г/моль = 17,6г
mкон. р-р = 450,4 г * 2/3 + 245 г – 17,6 г = 527,7 г
w(H2SO4) = 29,4 г / 527,7 г = 0,0557
ОТВЕТ: w(H2SO4) = 0,0557 или 5,57%
Ошибка.
Попробуйте повторить позже
Навеску фосфида цинка массой 25,7 г растворили в насыщенном при некоторой температуре растворе гидроксида натрия массой 92,3 г. К образовавшемуся раствору добавили 180,32 г 45%-го раствора серной кислоты. Вычислите массовую долю сульфата цинка в конечном растворе, если растворимость гидроксида натрия, сульфата цинка и сульфата натрия в условиях задачи составляет 108,7 , 22,0 и 19,2 г/100 г воды.
Сразу разберемся, какова может быть массовая доля соединений в их насыщенных растворах. Она может быть и меньше полученного значения, если в растворе помимо воды есть ещё растворенные вещества.
ω NaOH насыщ = 108,7/ (100 + 108,7) = 0,52
ω Na2SO4 насыщ = 0,161
ω ZnSO4 насыщ = 0,18
n (NaOH) = m раствора * ω / M = 1,2 моль
n (Zn3P2) = m / M = 0,1 моль
1) Zn3P2 + 6NaOH + 6H2O → 3Na2[Zn(OH)4] + 2PH3
n NaOH избыток = 1,2 - 0,6 = 0,6 моль
n H2SO4 = m раствора * ω / M = 0,92 моль
2) 2 NaOH + H2SO4 = Na2SO4 + 2 H2O
n H2SO4 ост2 = 0,92 - 0,3 = 0,62 моль
3) 2 H2SO4 + Na2[Zn(OH)4] = Na2SO4 + ZnSO4 + 4 H2O
n H2SO4 ост3 = 0,62 - 0,6 = 0,02 моль
Найдем массу воды и солей в итоговом растворе:
m (H2O) = m (H2O) из раствора NaOH + m (H2O) из раствора H2SO4 - m (H2O) израсх 1 + m (H2O) образ 2 +3 = 92,3 * (1-0,52) + 180,32*(1-0,2) - 0,6*18 + 0,6*18 + 4*0,3*18 = 210,16 г
m ZnSO4 = 0,3 * 161 = 48,3 г
m Na2SO4 = 0,3 * 142 = 42,6 г
Обе эти соли выпадут в осадок. В 210,16 г воды должно растворяться в 2,1 раза большее количество соли, чем в 100 г воды - соответственно для сульфата цинка и натрия 46,2 и 40,3 г
Выпадет в осадок соответственно 2,1 г сульфата цинка и 2,3 г сульфата натрия.
Итоговая масса раствора = m р-ра NaOH + m Zn3P2 + m р-ра H2SO4 - m PH3 - m солей, выпавших в осадок = 92,3 + 180,32 + 25,7 - 0,2*(31+3) - 2,1 - 2,3 = 287,12 г
ω ZnSO4 итог = (48,3-2,1)/281,12 = 0,164 или 16,4%

Ошибка.
Попробуйте повторить позже
Кристаллогидрат сульфата алюминия, в котором массовая доля серы меньше массовой доли кислорода в 5 раз, растворили в воде с образованием раствора массой 722,4 г. Полученный раствор подвергли электролизу до выделения на аноде 35,84 л (н.у.) газа. К образовавшемуся раствору добавили 424 г 10 %-го раствора карбоната натрия, после всех реакций его массовая доля уменьшилась в 10 раз. Определите массу растворенного кристаллогидрата сульфата алюминия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Пусть формула кристаллогидрата сульфата алюминия имеет вид Al2(SO4)3 * xH2O
Пусть количество кристаллогидрата равно 1 моль, тогда:
n(S) = 3 моль
n(O) = 12 + x моль
Пользуясь условием об отношении массовых долей элементов получаем уравнение:
((12 + x) моль * 16 г/моль) / (3 моль * 32 г/моль) = 5
Решая это уравнение, получаем, что х = 18 моль. Следовательно, кристаллогидрат сульфата алюминия выглядит следующим образом: Al2(SO4)3 * 18H2O
При электролизе сульфата алюминия происходит электролиз воды:
1) 2H2O = 2H2 + O2
n(O2) = 35,84 л / 22,4 л/моль = 1,6 моль
n(H2O) = 2n(O2) = 3,2 моль
Найдем массу раствора после реакции:
mр-ра = 722,4 г - 18 г/моль * 3,2 моль = 664,8 г
Найдем количество вещества карбоната натрия:
n(Na2CO3) = (424 г * 0,1) / 106 г/моль = 0,4 моль
2) Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 3Na2SO4
По условию задачи, карбонат натрия остался в растворе после завершения реакции, из чего можно сделать вывод, что в недостатке находился сульфат алюминия. Пусть его в растворе было z моль. Тогда прореагировало 3z моль карбоната натрия, образовалось 2z моль гидроксида алюминия и 3z моль оксида углерода (IV).
Найдем конечную массу раствора:
mр-ра кон = 664,8 г + 424 г - 2z моль * 78 г/моль - 3z моль * 44 г/моль = 1088,8 - 288z г
nост(Na2CO3) = 0,4 - 3z моль
mост(Na2CO3) = (0,4 - 3z) моль * 106 г/моль = 42,4 - 318z г
По условию задачи, массовая доля карбоната натрия в конечном растворе составляет 1%:
w(Na2CO3) = (42,4 - 318z) г / (1088,8 - 288z) г = 0,01
Решая данное уравнение, находим, что z = 0,1 моль
Зная количество сульфата алюминия, можем вычислить массу кристаллогидрата:
m(Al2(SO4)3 * 18H2O) = 0,1 моль * 666 г/моль = 66,6 г
Ответ: 66,6 г
- 66,6
- 66.6
Ошибка.
Попробуйте повторить позже
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор карбоната натрия массой 395,4 г. Приготовленный раствор разделили на две части. К первой части прилили избыток раствора нитрата кальция, при этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
В ответе запишите уравни реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин)
Записаны уравнения реакций:
1) Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3
2) Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Рассчитаны количество вещества реагентов и продуктов реакции:
m(Na2CO3) = 395,4 * 31,8 / (31,8 + 100) = 95,4 г
n(Na2CO3) = 95,4 / 106 = 0,9 моль
n(CaCO3) = 50 / 100 = 0,5 моль
n1(Na2CO3) = n(CaCO3) = 0,5 моль
n2(Na2CO3) = 0,9 - 0,5 = 0,4 моль
m(HNO3) = 252 * 0,3 = 75,6 г
n(HNO3) = 75,6 / 63 = 1,2 моль - избыток
n(HNO3)ост. = 1,2 - (0,4 * 2) = 0,4 моль
m(HNO3)ост. = 0,4 * 63 = 25,2 г
n(CO2) = n2(Na2CO3) = 0,4 моль
m(CO2) = 44 * 0,4 = 17,6 г
Вычислена массовая доля азотной кислоты в растворе:
mр-ра(Na2CO3) = 395,4 * 0,4 / 0,9 = 175,7 г (вторая часть раствора)
mр-ра кон. = 175,7 + 252 - 17,6 = 410,1 г
w(HNO3) = 25,2 / 410,1 = 0,06 (6%)
Ошибка.
Попробуйте повторить позже
Медный купорос ( CuSO4 * 5H2O) массой 12,5 г расторили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции добавили 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
n(CuSO4*5H2O)= 12,5/250 = 0,05 моль
Найдем количество добавленной воды для получения 20% раствора
0,2 = m(CuSO4)/ m(CuSO4*5H2O) + m(H2O) = 0,05*150/12,5+m(H2O)
m(H2O) = 27,5г
m(р-ра) = 27,5 + 12,5 = 40г
CuSO4 + Fe = FeSO4 + Cu
n(FeSO4) =n(Cu) = n(CuSO4) (недостаток) = 0,05 моль
n(Fe(ост))= 5,6/56 - n(Fe (прореаг))= 0,05 моль. железа прореагировала половина, то есть 2,8 г
n(Na2S) = m(р-ра)* w /M = 0,15 моль
Na2S + FeSO4 = Na2SO4 + FeS
n(FeS) = n(FeSO4) (недостаток) = 0,05 моль
n(Na2S ост) = 0,15 - 0,05 = 0,1 моль
w(Na2S) = m(Na2S ост)/m р-ра = 0,1*78/ m(р-ра CuSO4 )+ m( Fe прореаг.) - m(Cu) + m(р-ра Na2S) - m(FeS) = 7,8/152,2=0,051 или 5,1%
- 5,1
- 5.1




