Ошибка.
Попробуйте повторить позже
Провели электролиз 312 г 15%-ного раствора хлорида натрия. После того как на аноде выделилось 6,72 л газа, процесс остановили. Из полученного раствора отобрали порцию раствора массой 58,02 г. Вычислите массу подогретого до 40°С 20%-ного раствора сульфата меди (II), который может прореагировать с отобранной порцией раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и проведите все необходимые вычисления.
n(NaCl) = (mр-ра * w(NaCl)) / M(NaCl) = (312 г * 0,15) / 58,5 г/моль = 0,8 моль
1) 2NaCl + 2H2O = 2NaOH + H2 + Cl2
n(Cl2) = V(Cl2) / VM = 6,72 л / 22,4 л/моль = 0,3 моль
nост(NaCl) = 0,8 моль - 2n(Cl2) = 0,8 моль - 0,6 моль = 0,2 моль
n(NaOH) = 2n(Cl2) = 0,6 моль
mр-ра = 312 г - m(H2) - m(Cl2) = 312 г - 0,6 г - 21,3 г = 290,1 г
Масса отобранной порции 58,02 г, что составляет 58,02 г / 290,1 г = 1/5 части раствора, следовательно, в отобранной порции в 5 раз меньше хлорида натрия и гидроксида натрия:
n(NaCl) = 0,2 моль / 5 = 0,04 моль
n(NaOH) = 0,6 моль / 5 = 0,12 моль
2) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
n(CuSO4) = 1/2n(NaOH) = 0,12 моль / 2 = 0,06 моль
m(CuSO4) = n(CuSO4) * M(CuSO4) = 0,06 моль * 160 г/моль = 9,6 г
mр-ра(СuSO4) = m(СuSO4) / M(CuSO4) = 9,6 г / 0,2 = 48 г
Ответ: 48 г
Ошибка.
Попробуйте повторить позже
Через 64 г 15%-ного раствора сульфата меди (II) пропускали электрический ток до тех пор, пока на аноде не выделилось 1120 мл (н.у.) газа. К образовавшемуся раствору добавили 66,56 г 25 %-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Уравнения реакций:
1) 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
2) 2H2O = 2H2 + O2 (электролиз)
3) BaCl2 + H2SO4 = BaSO4 + 2HCl
Расчёт количества вещества реагентов и массы продуктов реакций:
m(CuSO4) = 64 * 0,15 = 9,6 г
n(CuSO4) = 9,6 / 160 = 0,06 моль
n(O2) = 1,12 / 22,4 = 0,05 моль
n(Cu) = n(CuSO4) = 0,06 моль
m(Cu) = 0,06 * 64 = 3,84 г
n(H2SO4) = n(CuSO4) = 0,06 моль
n(O2)(1) = 0,5n(CuSO4) = 0,03 моль
n(O2)(2) = 0,05 - 0,03 = 0,02 моль
n(H2O)прореаг. = 2n(O2) = 0,04 моль
m(H2O)прореаг. = 0,04 * 18 = 0,72 г
m(O2)(1) = 32 * 0,03 = 0,96 г
m(BaCl2) = 66,56 * 0,25 = 16,64 г
n(BaCl2) = 16,64 / 208 = 0,08 моль
n(BaCl2)прореаг. = n(H2SO4) = 0,06 моль
n(BaCl2)ост. = 0,08 - 0,06 = 0,02 моль
m(BaCl2)ост. = 0,02 * 208 = 4,16 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,06 моль
m(BaSO4) = 0,06 * 233 = 13,98 г
Вычислена массовая доля хлорида бария в растворе:
m(р-ра) = 64 + 66,56 - 3,84 - 0,72 - 13,98 - 0,96 = 111,06 г
w(BaCl2) = 4,16 / 111,6 = 0,037 или 3,7%
Ошибка.
Попробуйте повторить позже
Через 522 г 10%-ного раствора нитрата бария пропускали электрический ток до тех пор, пока на катоде не выделилось 94,08 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный при некоторой температуре раствор, полученный добавлением к воде медного купороса (CuSO4 ∙ 5H2O) массой 100 г. В результате реакции массовая доля сульфата меди(II) в растворе уменьшилась в 4 раза. Вычислите растворимость (в г на 100 г воды) сульфата меди(II) при данной температуре.
Ba(NO3)2 электролизу не подвергается, поэтому будет только электролиз воды:
1) 2H2O = 2H2 + O2 (электролиз)
На катоде выделялся водород в количестве:
n(H2) = 94.08 / 22.4 = 4.2 моль.
По уравнению реакции:
n(H2O) прореаг. = n(H2) = 94.08 / 22.4 = 4.2 моль.
m(Ba(NO3)2) = 0.1 * 522 = 52.2 г
n(Ba(NO3)2) = 52.2 / 261 = 0.2 моль.
m(р-ра после 1) = 522 - 4.2 * 18 = 446.4 г
2) Ba(NO3)2 + CuSO4 = BaSO4 + Cu(NO3)2 (Ba(NO3)2) - недостаток)
n(CuSO4 * 5H2O) = 100 / 250 = 0.4 моль
n(CuSO4) = n(CuSO4 * 5H2O) = 0.4 моль
m(CuSO4) = 0.4 * 160 = 64 г
n(H2O) = 5 * n(CuSO4 * 5H2O) = 2 моль
m(H2O) = 18 * 2 = 36 г
n(CuSO4) ост. = 0.4 - 0.2 = 0.2 моль
Пусть m(H2O), добавленной к медному купоросу - х г, тогда
W(CuSO4) насыщ. = 64 / 100 + х
W(CuSO4) после 2 р-ции = (0,2 * 160) / 446.4 + 100 + х - (0.2*233) = 32 / 499.8 + х
По условию задачи:
W(CuSO4) насыщ. = W(CuSO4) после 2 р-ции * 4
64 / 100 + х = 128 / 499.8 + х
х = 299. 8 г
Составим и решим пропорцию:
m(CuSO4) в насыщ. р-ре / m(CuSO4) на 100 г воды = m(H2O) в насыщ. р-ре / 100 г H2O
64 / m(CuSO4) на 100 г воды = 335.8 / 100
m(CuSO4) на 100 г воды = 64 * 100 / 335.8 = 19 г
Ответ: растворимость CuSO4 при данной температуре составляет 19 г на 100 г воды
Ошибка.
Попробуйте повторить позже
Через 522 г 5%-ного раствора нитрата бария пропускали электрический ток до тех пор, пока на аноде не выделилось 8,4 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 96,6 г глауберовой соли (Na2SO4 ∙ 10H2O) в необходимом количестве воды. При этом массовая доля сульфата натрия в растворе уменьшилась в 4,5 раза. Вычислите растворимость сульфата натрия при комнатной температуре (в г на 100 г воды).
Ba(NO3)2 электролизу не подвергается, поэтому будет только электролиз воды:
1) 2H2O = 2H2 + O2 (электролиз)
На аноде выделялся кислород в количестве:
n(O2) = 8.4 / 22.4 = 0.375 моль.
По уравнению реакции:
n(H2O) прореаг. = 2n(O2) = 0.75 моль.
m(H2O) прореаг. = 0.75 * 18 = 13.5 г
m(Ba(NO3)2) = 0.05 * 522 = 26.1 г
n(Ba(NO3)2) = 26.1 / 261 = 0.1 моль.
m(р-ра после 1) = 522 - 13.5 = 508.5 г
2) Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3 (Ba(NO3)2) - недостаток)
n(Na2SO4 * 10H2O) = 96.6 / 322 = 0.3 моль
n(Na2SO4) = n(Na2SO4 * 10H2O) = 0.3 моль
m(Na2SO4) = 0.3 * 142 = 42.6 г
n(H2O) = 10 * n(Na2SO4 * 10H2O) = 3 моль
m(H2O) = 18 * 3 = 54 г
n(Na2SO4) ост. = 0.3 - 0.1 = 0.2 моль
Пусть m(H2O), добавленной к глауберовой соли - х г, тогда
W(Na2SO4) насыщ. = 42.6 / 96.6 + х
W(CuSO4) после 2 р-ции = (0,2 * 142) / 508.5 + 96.6 + х - (0.1*233) = 28.4 / 581.8 + х
По условию задачи:
W(CuSO4) насыщ. = W(CuSO4) после 2 р-ции * 4.5
42.6 / 96.6 + х = 127.8 / 581.8 + х
х = 146 г
Составим и решим пропорцию:
m(Na2SO4) в насыщ. р-ре / m(Na2SO4) на 100 г воды = m(H2O) в насыщ. р-ре / 100 г H2O
42.6 / m(Na2SO4) на 100 г воды = 200 / 100
m(Na2SO4) на 100 г воды = 42.6 * 100 / 200 = 21.3 г
Ответ: растворимость Na2SO4 при комнатной температуре составляет 21,3 г на 100 г воды
Ошибка.
Попробуйте повторить позже
Через 400 г 36%-ного раствора нитрата железа(II) пропустили электрический ток. При этом объём газа, выделившегося на катоде, оказался в 2 раза меньше объёма газа, выделившегося на аноде, а массовая доля нитрата железа(II) уменьшилась до 10,19%. К полученному раствору добавили 120 г 40%-ного раствора карбоната аммония. Вычислите массовую долю нитрата железа(II) в конечном растворе. Возможными процессами окисления ионов Fe2+ и их осаждения из околокатодного пространства пренебречь.
m(Fe(NO3)2) = 0.36 * 400 = 144 г
n(Fe(NO3)2) = 144 / 180 = 0.8 моль
1) 2Fe(NO3)2 + 2H2O = 2Fe + O2 + 4HNO3 (электролиз)
2) 2H2O = 2H2 + O2 (электролиз)
На катоде выделялся водород, на аноде в обеих реакциях выделялся кислород. Пусть n(O2) в 1 реакции - х моль, n(O2) во 2 реакции - у моль. По условию задачи составим уравнение:
V(H2) * 2 = V(O2)1 и 2 р-ции, так как это газы при н.у., то
n(H2) * 2 = n(O2)1 и 2 р-ции
4y = x + y
3y = x.
W(Fe(NO3)2) = m(Fe(NO3)2) после р-ций / m р-ра после реакций 1 и 2
m(Fe(NO3)2) после р-ций = M*n = 180 * (0.8 - 2х) = 144 - 360х
m р-ра после реакций 1 и 2 = m(Fe(NO3)2) р-ра исх. - m(Fe) - m(CO2) - m(H2O) прореаг. = 400 - 112х - 32х - 12х = 400 - 156х
По условию задачи:
W(Fe(NO3)2) = (144 - 360х) / (400 - 156х) = 0.1019, отсюда
х = 0.3
у = 0.1.
По уравнению реакции 1:
n(Fe(NO3)2) ост. = 0.8 - 0.6 = 0.2 моль
n(HNO3) = 0.3 * 4 = 1.2 моль
m р-ра после реакций 1 и 2 = 400 - 156 * 0.3 = 353.2 г
n((NH4)2CO3) = m / M = (120 * 0.4) / 96 = 0.5 моль
3) (NH4)2CO3 + 2HNO3 = 2NH4NO3 + CO2 + H2O
m(CO2) = 44 * 0.5 = 22 г
m кон. р-ра = m р-ра после реакций 1 и 2 + m((NH4)2CO3 ) р-р - m(CO2) = 353.2 + 120 - 22 = 451.2 г
W(Fe(NO3)2) = m(Fe(NO3)2) / m кон. р-ра = (0.2 * 180) / 451.2 = 0.08 или 8%
Ответ: W(Fe(NO3)2) = 8%
Ошибка.
Попробуйте повторить позже
Через 522 г 10%-го раствора нитрата бария пропускали электрический ток до тех пор, пока на катоде не выделилось 94,08 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный при некоторой температуре раствор, полученный добавлением к воде медного купороса массой 100 г. В результате реакции массовая доля сульфата меди (II) в растворе уменьшилась в 4 раза. Вычислите растворимость (в г на 100 г воды) сульфата меди (II) при данной температуре.
1) 2H2O = 2H2 + O2
2) CuSO4 + Ba(NO3)2 = BaSO4 + Cu(NO3)2
m(Ba(NO3)2) = 0,1 * 522 = 52,2 г
n(Ba(NO3)2) = 52,2 / 261 = 0,2 моль
n(H2) = 94,08 / 22,4 = 4,2 моль
n(H2O) = n(H2) = 4,2 моль
m(H2O) = 18 * 4,2 = 75,6 г
mр-ра(Ba(NO3)2) = 522 - 75,6 = 446,4 г
n(CuSO4 * 5H2O) = 100 / 250 = 0,4 моль
n(CuSO4) = 0,4 моль
m(CuSO4) = 0,4 * 160 = 64 г
n(CuSO4)прореаг. = 0,2 моль
n(CuSO4)ост = 0,2 моль
m(CuSO4)ост = 0,2 * 160 = 32 г
n(BaSO4) = 0,2 моль
m(BaSO4) = 0,2 * 233 = 46,6 г
Пусть mисх р-ра(CuSO4) = х г, тогда
w(CuSO4)исх = 64 / х
w(CuSO4)ост = 32 / (х + 446,4 - 46,6) = 32 / (х + 399,8)
w(CuSO4)исх = 4w(CuSO4)ост
64 / х = (4 * 32) / (х + 399,8)
х = 399,8 г
m(H2O)исх = 399,8 - 64 = 335,8 г
растворимость CuSO4 = (64 * 100) / 335,8 = 19 г на 100 г воды
Ошибка.
Попробуйте повторить позже
Через 400 г 36%-го раствора нитрата железа (II) пропустили электрический ток. При этом объем газа, выделившегося на катоде, оказался в 2 раза меньше объема газа, выделившегося на аноде, а массовая доля нитрата железа (II) уменьшилась до 10,19%. К полученному раствору добавили 120 г 40%-го раствора карбоната аммония. Вычислите массовую долю нитрата железа (II) в конечном растворе. Возможными процессами окисления Fe2+ и их осаждения из околокатодного пространства пренебречь.
1) 2Fe(NO3)2 + 2H2O = 2Fe + 4HNO3 + O2
2) 2H2O = 2H2 + O2
3) 2HNO3 + (NH4)2CO3 = 2NH4NO3 + CO2 + H2O
Рассчитаны количества вещества реагентов и масса продуктов реакций:
m(Fe(NO3)2) = 0,36 * 400 = 144 г
n(Fe(NO3)2) = 144 / 180 = 0,8 моль
Пусть в реакции (2) выделялось х моль кислорода, тогда
n(H2) = 2х моль
n(O2)(1) = 3x моль
n(Fe(NO3)2)прореаг. = 6x моль
m(Fe(NO3)2)прореаг. = 6х * 180 = 1080х г
mр-ра(Fe(NO3)2)оставш. = 400 - 4 * 32х - 4х - 6 * 56х = 400 - 468х г
w(Fe(NO3)2)оставш. = (144 - 1080х) / (400 - 468х) = 0,1019
х = 0,1 моль
n(O2)(1) = 0,3 моль
n(HNO3) = 1,2 моль
m((NH4)2CO3) = 0,4 * 120 = 48 г
n((NH4)2CO3) = 48 / 96 = 0,5 моль
n(CO2) = 0,5 моль
m(CO2) = 0,5 * 44 = 22 г
m(Fe(NO3)2)оставш. = 144 - 0,6 * 180 = 36 г
mр-ра кон.(Fe(NO3)2) = 400 - 0,1 * 468 + 120 - 22 = 451,2 г
w(Fe(NO3)2) = 36 / 451,2 = 0,08 или 8%

Ошибка.
Попробуйте повторить позже
Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у,) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = NaNO3 + AgCl
n(O2) = 1,12 / 22,4 = 0,05 моль
n(Ag) = 4n(O2) = 0,2 моль
m(Ag) = 108 * 0,2 = 21,6 г
m(AgNO3) = 340 * 0,2 = 68 г
n(AgNO3) = 68 / 170 = 0,4 моль
n(AgNO3) прореаг. = 0,2 моль
n(AgNO3) ост. = 0,4 - 0,2 = 0,2 моль
m(AgNO3) ост. = 170 * 0,2 = 34 г
m(р-ра) = 340 - 1,6 - 21,6 = 316,8 г
W(AgNO3) ост.= 34 / 316,8 = 0,107
m(AgNO3) = 0,107 * 79,44 = 8,5 г (в отобранной порции)
n(AgNO3) = 8,5 / 170 = 0,05 моль (в отобранной порции)
n(NaCI) = n(AgNO3 в отобранной порции) = 0,05 моль
m(NaCI) = 58,5 * 0,05 = 2,925 г
m(NaCI p-pa) = 2,925 / 0,1 = 29,25 г
Ошибка.
Попробуйте повторить позже
Через 64 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 1120 мл (н.у.) газа. К образовавшемуся раствору добавили 66,56 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
1) 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
2) 2H2O = 2H2 + O2 (электролиз)
3) BaCl2 + H2SO4 = BaSO4 + 2HCl
Рассчитываем количсетво вещества реагентов и массу продуктов реакций:
m(CuSO4) = 64х0,15 = 9,6 г
n(CuSO4) = 9,6/160 =0,06 моль
n(O2) = 1,12 / 22,4 = 0,05 моль
n(Cu) = n(CuSO4) = 0,06
m(Cu) = 0,06×64 = 3,84 г
n(H2SO4) = n(CuSO4) = 0,06 моль
n(O2)(1) = 0,5n(CuSO4) = 0,03 моль
n(O2)(2) = 0,05 - 0,03 = 0,02 моль
n(H2O)прореаг. = 2n(O2) = 0,04 моль
m(H2O)прореаг. = 0,04×18 = 0,72 г
m(O2)(1) = 32×0,03 = 0,96 г
m(BaCl2) = 66,56×0,25 = 16,64 г
n(BaCl2) = 16,64 / 208 = 0,08 моль
n(BaCl2)прореаг. = n(H2SO4) = 0,06 моль
n(BaCl2)ост. = 0,08 - 0,06 = 0,02 моль
m(BaCl2)ост. = 0,02×208 = 4,16 г
n(BaSO4) n(BaCl2 прореаг.) = 0,06 моль
m(BaSO4) = 0,06×233 = 13,98 г
Вычислим массовую долю хлорида бария в растворе:
m(р-ра) = 64+ 66,56 - 3,84 - 0,72 - 13,98 - 0,96 = 111,06 г
w(BaCl2) = 4,16 / 111,06 = 0,037 или 3,7%

Ошибка.
Попробуйте повторить позже
При пропускании тока через раствор сульфата натрия массой 300 г, в котором на каждые 169 протонов серы приходится 1500 протонов водорода, на катоде выделилось 50 л газа (н.у). Определите объем газа, выделившегося на аноде и массовую долю сульфата натрия в полученном растворе.
Пусть n(Na2SO4) - х моль, n(H2O) - у моль, тогда
m(Na2SO4) = 142х г
m(H2O) = 18у г
m(р+ S в р-ре) = 16x г
m(p+ H в р-ре) = 2у г.
По условию задачи можем составить соотношение:
169/1500 = m(р+ S в р-ре)/m(р+ Н в р-ре) = 16x/2y.
m(р-ра) = m(Na2SO4) + m(H2O) = 300 г
Составим и решим систему уравнений:
169/1500 = 16x/2y
142x + 18y = 300
x = 0,211
y = 15.
m(Na2SO4) = 0,211*142 = 30 г
1) 2H2O = 2H2 + O2
На катоде выделялся Н2, следовательно,
V(H2) = 50 л
n(H2) = 50/22,4 = 2,232 моль
n(H2O прореаг.) = 2,232 моль.
По условию реакции можем определить объём газа, выделившегося на аноде, - О2:
V(O2) = V(H2)/2 = 50/2 = 25 л.
m(H2O прореаг.) = 2,232*18 = 40,176 г
m(кон. р-ра) = 300 - 40,176 = 259,824 г
w(Na2SO4) = 30/259,824 = 0,1155 или 11,55%
Ответ: V(O2) = 25 л,
w(Na2SO4) = 11,55%
- 11,55
- 11.55
- 25
Ошибка.
Попробуйте повторить позже
Через 526,5 г раствора хлорида натрия, в котором массовая доля всех протонов составляет 54,7%, пропускали электрический ток. Когда на аноде выделилось 22,4 л газа (н.у), электрический ток отключили. К образовав-шемуся в результате электролиза раствору добавили 13 г цинка. Определите массовую долю всех протонов в конечном растворе.
Пусть n(NaCl) - х моль, а n(H2O) - у моль, тогда
m(NaCl) = 58,5х г
m(H2O) = 18у г
m(р+ в NaCl) = 28x г
m(p+ в H2O) = 10у г.
m(p+ в р-ре) = m(р+ в NaCl) + m(p+ в H2O) = 0,547*526,5 = 288 г
m(р-ра) = m(NaCl) + m(H2O) = 526,5 г
Составим и решим систему уравнений:
526,5 = 18у + 58,5х
288 = 28х + 10у
х = 1
у = 26
1) 2NaCl + 2H2O = 2NaOH + Cl2 + H2
На аноде выделялся Сl2.
n(газа на аноде) = 22,4/22,4 = 1 моль
По уравнению реакции при полном электролизе NaCl может выделиться только 0,5 моль Сl2, следовательно, прошёл также и электролиз воды.
2) 2H2O = 2H2 + O2
На аноде выделялся О2.
n(O2) = 1 - 0,5 = 0,5 моль
n(H2O после электролиза) = 26 - 1 - 1 =24 моль
n(Zn) = 13/65 = 0,2 моль
3) 2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2
m(p+) = m(p+ H2O после электролиза) + m(p+NaOH) + m(p+ Zn) - m(p+H2)
m(p+) = (24*10 + 20*1 + 30*0,2 - 2*0,2)*1 = 265,6 г
m(кон. р-ра) = m(исх. р-ра NaCl) - m(Cl2) - m(H2) - m(H2O) + m(Zn) - m(H2)
m(кон. р-ра) = 526,5 - 0,5*71 - 0,5*2 - 18*1 + 13 - 0,2*2 = 484,6 г
w(p+) = 265,6/484,6 = 0,548 или 54,8%
Ответ: 54,8%
- 54.8
- 54,8
Ошибка.
Попробуйте повторить позже
Провели полный электролиз соли, содержащейся в растворе хлорида натрия (p =1,12 г/мл), в котором на 100 протонов соли приходится 679 протонов воды. По окончанию реакции получили 125 г гидроксида натрия. Какой объем раствора хлорида натрия использовали?
2NaCl + 2H2O = 2NaOH + Cl2 + H2
n(NaOH) = 125/40 = 3,125 моль
По условию реакции:
n(NaCl) = 3,125 моль.
n(протонов в NaCl) = 3,125*28 = 87,5 моль (число протонов в NaCl находим исходя из порядковых номеров элементов в таблице Менделеева)
Составим соотношение с использованием данных условия задачи:
100/679 = 87,5/n(протонов в H2O).
n(протонов в H2O) = (87,5*679)/100 = 594,125 моль
n(H2O) = 594,125/10 = 59,413 моль
m(H2O) = 59,413*18 = 1069,434 г
m(NaCl) = 3,125*58,5 = 182,813 г
m(исх. р-ра) = 1069,434 + 182,813 = 1252,247 г
V(исх. р-ра) = 1252,247/1,12 = 1118 мл
Ответ: 1118 мл
Ошибка.
Попробуйте повторить позже
Объём газов, выделившихся при электролизе водного раствора хлорида натрия, равен 1,344 л (при н.у.). Продукт анодной реакции ввели во взаимодействие с 40 мл горячего раствора гидроксида калия с концентрацией 3 моль/л. Определите, какие вещества(кроме воды) и в каких количествах по массе будут находиться в растворе после окончания реакции.
Уравнения реакций:
(1) 2NaCl + 2H2O = 2NaOH + H2 + Cl2
(2) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
n(KOH) = 0.04*3 = 0.12 моль
По уравнению (1):
n(Cl2) = n(H2), следовательно,
V(Cl2) = V(H2) = 1.344/2 = 0.672 л
n(Cl2) = 0.672/22.4 = 0.03 моль.
По уравнению (2):
определяем, что KOH в избытке, Сl2 в недостатке
n(KOH)изб. = 0.12 - 0.06 = 0.06 моль
m(KOH)изб = 0.06*56 = 3.36 г
n(KCl) = 0.03*5/3 = 0.05 моль
m(KCl) = 0.05*(39 +35.5) = 0.05*74.5 = 3.725 г
n(KClO3) = 0.03*1/3 = 0.01 моль
m(KClO3) = 0.01*(39 + 35.5 + 16*3) = 0.01*122.5 = 1.225 г
Ответ: в растворе будет находиться: m(KOH)= 3.36 г, m(KCl) = 3.725 г, m(KClO3) = 1.225 г
Ошибка.
Попробуйте повторить позже
Какой объем газа (при н.у.) выделится на аноде при электролизе расплава хлорида калия, если на катоде выделяется 11,7 г металла?
Электролиз расплава хлорида калия:
2KCl → 2K + Cl2↑
А(К) = 39 г/моль.
n(K) = 11,7/39 = 0,3 моль;
n(Cl2) = n/2(K) = 0,3/2 = 0,15 моль;
V(Cl2) = 22,4 ⃰0,15 = 3,36 л.
- 3.36
- 3,36
Ошибка.
Попробуйте повторить позже
Имеется 500 г раствора, содержащего 12,8 г смеси нитратов меди (II) и серебра (I). Раствор подвергли полному электролизу и получили 5,36 г смеси металлов. Найдите массовые доли нитратов в растворе.
1) 2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
2) 4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3
Пусть n(Cu(NO3)2) = x моль, а n(AgNO3) = y моль
Тогда по условию о массе смеси солей получаем уравнение:
188х + 170у = 12,8 г
По уравнениям реакций количество меди после полного электролиза составило х моль, количество серебра у моль, тогда из массы смеси металлов получаем второе уравнение:
64х + 108у = 5,36 г
Решая систему уравнений, находим х и у:
х = 0,05 моль, у = 0,02 моль
Находим изначальные массы нитратов и их массовые доли:
m(Cu(NO3)2) = 188 г/моль * 0,05 моль = 9,4 г
w(Сu(NO3)2) = 9,4 г / 500 г = 0,0188 (1,88 %)
m(AgNO3) = 170 г/моль * 0,02 моль = 3,4 г
w(AgNO3) = 3,4 г / 500 г = 0,0068 (0,68 %)
- 0,0068
- 0.0068
- 0,68
- 0.68
Ошибка.
Попробуйте повторить позже
Через 100 г раствора сульфата меди с массовой долей соли 10 % пропускали электрический ток до тех пор, пока на аноде не выделилось 560 мл газа (н.у.). Определите массовые доли веществ в образовавшемся растворе.
Катод: Cu2+ + 2 ē → Cuo ↓ · 2
Анод: 2Н2О - 4ē → О2↑ + 4Н+ Суммарное уравнение в ионном виде:
2Cu2+ +2Н2О → 2Cuo↓+О2↑ +4Н+ Суммарное уравнение в молекулярном виде:
2CuSO4 + 2H2O → 2Cuo ↓ +О2↑ + 2H2SO4
2) Определяем количества веществ сульфата меди в исходном растворе и кислорода,
выделившегося на аноде:
ν( CuSO4) = 100 · 0,1 / 160 = 0,0625 моль. ν(О2) = 0,560 / 22,4 = 0,025 моль.
Если бы электролиз сульфата меди прошел полностью, то, согласно уравнению реак- ции, кислорода должно было бы выделиться 0,0625 / 2 = 0,03125 моль, что больше, чем выделилось на самом деле. Следовательно, электролиз прошел не до конца и в растворе остался сульфат меди:
Было: 0,0625
2CuSO4 + 2H2O → 2Cuo ↓ +О2↑ + 2H2SO4 + (CuSO4) Прореагировало: 0,05 стало: 0,05 0,025 0,05 0,0125
3) Определяем массовые доли веществ в конечном растворе:
m(H2SO4) = 98 · 0,05 = 4,9 г. m(CuSO4 в конечном растворе) = 0,0125 · 160 = 2 г.
m(конечного раствора) = m(исходного раствора) – m(Cu) – m(О2) = 100 – 0,05 · 64 – 0,025 · 32 = 96 г.
ω(H2SO4) = 4,9 / 96 = 0,051. ω(CuSO4 в конечном растворе) = 2 / 96 = 0,0208
- 2.08
- 2,08
- 5,1
- 5.1
Ошибка.
Попробуйте повторить позже
При электролизе раствора с массовой долей хлорида калия 20% получили 5,6 л хлора (н. у.) , а массовая доля соли изменилась на 9,5%. Найдите исходную массу раствора хлорида калия.
1) 2КСl + 2H2O = H2 + Cl2 + 2KOH
n(Cl2) = 5,6 л /22,4 л/моль = 0,25 моль = n(H2) = 0,5n(KCl)
Пусть масса изначального раствора х г. Тогда исходная масса соли 0,2х г. Найдем массу раствора после реакции:
х - m(Cl2) - m(H2) = x - 71 г/моль * 0,25 моль - 2 г/моль * 0,25 моль = х - 18,25 г
m прор.(KCl) = 0,5 моль * 74,5 г/моль = 37,25 г
Масса хлорида калия после реакции составила 0,2х - 37,25 г
Мы знаем, что массовая доля изменилась на 9,5%. Из того, что соль расходовалась в процессе реакции, делаем вывод, что изменилась в меньшую сторону. Таким образом, новая массовая доля составляет 20 - 9,5 = 10,5%
Значит, отношение массы соли к массе раствора принимает следующий вид:
(0,2х - 37,25) / (х - 18,25) = 0,105
Решая уравнение, находим х:
х = 372 г
Это и есть масса исходного раствора хлорида калия
- 372
Ошибка.
Попробуйте повторить позже
При проведении электролиза 624 г 10%-го раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа (н.у.). Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-го раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Hайдём массу и количество вещества исходного хлорида бария:
Запишем уравнение электролиза водного раствора хлорида натрия:
(1)
По уравнению (1):

- 47.7
- 47,7
Ошибка.
Попробуйте повторить позже
Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди (II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых величин).

Ошибка.
Попробуйте повторить позже
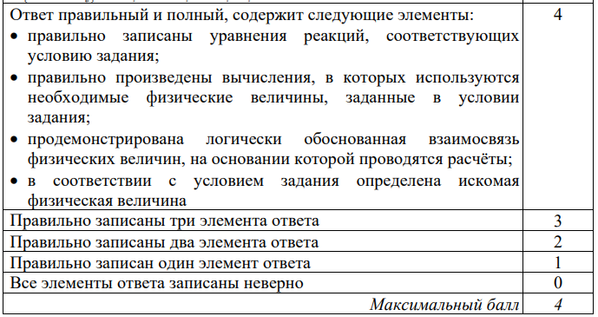
При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Hайдём массу и количество вещества исходного сульфата меди(II):
Запишем уравнение электролиза водного раствора сульфата меди(II):
(1)
По уравнению (1):