Ошибка.
Попробуйте повторить позже
Определите массовую долю карбоната кальция в образце мрамора, если в ходе реакции 220 г образца мрамора с избытком азотной кислоты выделилось 44,8 л (н.у.) газа. (Запишите число с точностью до десятых.)
Ошибка.
Попробуйте повторить позже
Определите объем прореагировавшего метана, если известно, что выход реакции составляет 95%, а объем полученного ацетилена 22,4 л (н.у.). (Запишите число с точностью до десятых)
Уравнение реакции:
2CH4 → C2H2 + 3H2
Количество полученного ацетилена:
n (C2H2) действ. = V (C2H2) / Vm = 22,4 л / 22,4 (л/моль) = 1 моль.
У реакции есть выход, следовательно, теоретическое количество продуктов не сходится с действительностью. Однако теоретическое количество реагентов сходится с действительным, это связано с тем, что данное количество реагентов в действительности не способно полностью 100% обращаться в данные продукты. В этом и есть суть выхода реакции.
Найдем теоретическое количество ацетилена:
95% = 0,95; n (C2H2) теор. = n (C2H2) действ. * выход реакции = 1 моль / 0,95 = 1,053 моль.
Найдем количество метана (теоретическое):
Соотношение коэффициентов метана и ацетилена составляет 2 к 1, следовательно, количество метана в 2 раза больше количества ацетилена.
n (CH4) = n (C2H2) теор. * 2 = 1,053 моль * 2 = 2,106 моль
Найдем объем метана:
V (CH4) = n (CH4) * Vm = 2,106 моль * 22,4 л/моль = 47,2 л (сразу округлив до десятых).
Мы нашли объем метана, это именно то, что мы искали.
Ошибка.
Попробуйте повторить позже
Объем (н.у.) углекислого газа, который теоретически образуется при сжигании 5 л (н.у.) угарного газа, равен
1) 5 л
2) 2,5 л
3) 7,5 л
4) 10 л
Для решения задачи следует составить уравнение реакции между угарным газом и кислородом:
2CO + O2 = 2CO2
Дальнейшее решение задачи можно осуществить с помощью пропорции. По уравнению реакции видно, что при сжигании 2 моль угарного газа образуется 2 моль углекислого газа. В соответствии с законом объемных отношений газов при сжигании 5 л этого CO образуется столько же литров CO2.
Ошибка.
Попробуйте повторить позже
При дегидратации 36,8 г этанола было получено 18,5 г диэтилового эфира. Определите выход (от теоретического) эфира в указанной реакции. Ответ запишите в процентах с точностью до десятых
- 62,5
- 62.5
Ошибка.
Попробуйте повторить позже
Из 92 г этилового спирта получили 16,8 л (н.у.) бутадиена-1,3. Рассчитайте выход бутадиена-1,3 в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
Образец оксида меди (II), содержащий в качестве примеси 5,7% меди, поместили в соляную кислоту. На растворение оксида меди (II) из указанного образца потребовалось 146 г хлороводорода. Вычислите массу нерастворившегося осадка меди. (Запишите число с точностью до десятых.)
Ошибка.
Попробуйте повторить позже
В результате взаимодействия бромида метиламыония массой 280 г с избытком гидроксида натрия был получен метиламин с выходом 80%. Определите объём (н. у.) выделившегося амина. (Запишите число с точностью до десятых.)
Ошибка.
Попробуйте повторить позже
При взаимодействии загрязненного образца гидрокарбоната натрия с гидроксидом натрия образовалось 286,2 г средней соли. Определите массу указанного образца, если известно, что массовая доля посторонних примесей составляет 5%. (Запишите число с точностью до десятых.)
Ошибка.
Попробуйте повторить позже
Образец оксида меди (II), содержащий 15% примесей меди, поместили в разбавленный раствор серной кислоты, При этом образовалось 352 г сульфата меди (II). Определите массу указанного образца. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
В результате нитрования 468 г бензола было получено 676,5 г нитробензола. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Нитрование бензола - реакция бензола с азотной кислотой, при которой один из водородов у бензола замещается нитрогруппой. Это описывает следующая реакция:
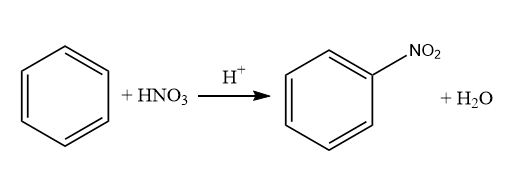
Найдем количество бензола:
n(бензола) = m(CO) / M(бензола) = 468 (г) / 78 (г/моль) = 6 (моль)
Исходя из коэффициентов уравнения найдем теоретическое количество нитробензола:
n(нитробензола) = n(бензола) * 1 = 6 (моль) * 1 = 6 (моль)
Найдем теоретическую массу нитробензола:
m(нитробензола) = n(нитробензола) * M(нитробензола) = 6 (моль) * 123 (г/моль) = 738 (г)
Найдем процентный выход реакции как отношение практической массы (из условия задачи) на теоретическую массу и домножим на 100%:
(m(практ.) / m(теор.)) * 100% = (676,5 (г) / 738 (г)) * 100% = 91,667% ≈ 92%
Ошибка.
Попробуйте повторить позже
Образец сульфида алюминия массой 25 г с содержанием примесей 10% поместили в раствор гидроксида калия, взятый в избытке, Определите массу тетрагидроксоалюмината калия, который образовался при этом. (Запишите число с точностью до десятых.)
Ошибка.
Попробуйте повторить позже
На взаимодействие с 1,5 кг технического поташа потребовалась соляная кислота, содержащая 730 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце указанного поташа. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
Какова масса продукта, образовавшегося в результате окисления 0,6 моль оксида серы(IV) кислородом? Выход продукта считать равным 75%. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
Определите объём (н.у.) ацетилена, который необходим для получения 0,3 моль бензола. Выход продукта считать равным 20%. (Запишите число с точностью до десятых.)
- 100,8
- 100.8
Ошибка.
Попробуйте повторить позже
Какая масса альдегида образуется при окислении 0,5 моль этанола оксидом меди(II)? Выход продукта считать равным 50%. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
Какой объём (н.у.) оксида азота(II) образуется при каталитическом окислении 0,56 моль аммиака кислородом? Выход продукта считать равным 100%. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
Вычислите объём газа (н.у.), полученного действием избытка раствора соляной кислоты на 200 г технического сульфида цинка, в котором массовая доля несульфидных примесей составляет 3%. (Запишите число с точностью до десятых.)
- 44,8
- 44.8
Ошибка.
Попробуйте повторить позже
Вычислите объём (н.у.) газа, полученного с выходом 85% при полном термическом разложении 158 г перманганата калия. (Запишите число с точностью до сотых.)
- 9,52
- 9.52
Ошибка.
Попробуйте повторить позже
При растворении в избытке соляной кислоты 5,4 г алюминия было получено 5,04 л (н.у.) газа. Определите выход газа в указанной реакции. (Запишите число с точностью до целых.)
Ошибка.
Попробуйте повторить позже
При сплавлении гидроксида калия с техническим ацетатом калия массой 2,2 г образовался метан объёмом 448 мл (н.у.). Вычислите массовую долю примесей в техническом образце ацетата калия. (Запишите число с точностью до целых.)



